El ácido ribonucleico ribosómico o ribosomal (ARNr o rRNA por sus siglas en inglés) es el tipo de ARN más abundante en las células y forma parte de los ribosomas que se encargan de la síntesis de proteínas según la secuencia de nucleótidos del ARN mensajero. Está formado por una sola cadena de nucleótidos (aunque presenta regiones de doble hélice intracatenaria).
Los ARN ribosómicos se han venido denominando tradicionalmente según su coeficiente de sedimentación, medido en svedbergs (S). De esta manera, en organismos procariotas existen tres ARNr distintos (5S, 16S y 23S) y en organismos eucariotas cuatro (5S, 5'8S, 18S, 28S).
En procariotas los ARNr 23S y 5S forman parte de la subunidad mayor de los ribosomas, mientras que el ARNr 16S forma parte de la subunidad menor.
En eucariotas los ARNr (ribosomales) 5S, 5'8S y 28S forman parte de la subunidad mayor de los ribosomas, mientras que el ARNr 18S forma parte de la subunidad menor.
En ambos casos, sobre el armazón constituido por los ARNr se asocian (dentro del núcleo celular) proteínas específicas, formando las subunidades ribosomales, que salen a través de los poros de la membrana nuclear al citoplasma lugar en el que desarrollan su función de síntesis proteica
martes, 11 de diciembre de 2012
5.1.3.4 Secuencias mitocondriales
La investigación de las características moleculares del genoma mitondrial (ADNmt) han sido
una de las primeras herramientas en ser exitosamente empleadas tanto en el campo de la
Antropología Molecular como en el de Genética Forense. Su análisis fue optimizado en forma
paulatina partiendo de los análisis de polimorfismos de restricción, empleados inicialmente,
hasta la secuenciación completa del genoma mitocondrial. Las características hereditarias del
ADNmt, restringida a la matrilínea y la ausencia de recombinación hacen de la información
polimórfica presente en la molécula de 16.569 pares de bases (pb) de longitud un elemento
identificatorio que posibilita el rastreo de un linaje materno o bien la correlación entre una
evidencia criminal y un posible emisor de la misma.
5.1.3.3 Micro satélites
Los microsatélites son tramos de secuencias simples de ADN con un alto grado de hipervariabilidad siendo abundantes y estando bien distribuidos en el genoma de eucariotas. Estas secuencias simples consisten en segmentos cortos de ADN con motivos repetidos, de 1 a 6 pares de bases, normalmente dinucleótidos, como ejemplo, la repetición simple de CA/TG que ocurre miles de veces en el genoma. El polimorfismo de los microsatélites viene dado por el número de repeticiones en un determinado locus, revelados como variación en la longitud de los fragmentos de los productos de PCR. Aunque los microsatélites se han usado ampliamente en genética molecular, todavía no se ha identificado su función en el genoma, la hipótesis más aceptable es que intervienen en el empaquetado y la condensación del ADN dentro de los cromosomas de eucariotas.
Los microsatélites están precedidos por unas secuencias flanqueantes o “primers” que deben ser determinadas, para su amplificación mediante PCR, pero, una vez hecho esto, debido a su alto nivel de polimorfismo, se pueden empelar en diferentes tipos de individuos; ya que se ha demostrado que se conservan entre diferentes poblaciones o razas de una misma especie, o incluso entre especies emparentadas como las gallinas y los pavos.
Tienen la ventaja de ser multialélicos, altamente polimórficos, con herencia mendeliana co-dominante, interpretación sencilla de los resultados, reproducibilidad muy alta, resultados transferibles entre laboratorios y posible automatización, además de obtenerse por PCR, por lo que se necesitan pequeñas cantidades de ADN. Por ello son herramientas apropiadas para el mapeo de ligamiento, identificación de QTL (quantitative trait loci), estimación de relaciones genéticas (distancias genéticas) entre diferentes poblaciones y tests de paternida; por lo tanto, se ha convertido en una técnica estándar para la evaluación molecular genética de cualquier población animal y humana.
http://artigoo.com/marcadores-de-adn-microsatelites
Los microsatélites están precedidos por unas secuencias flanqueantes o “primers” que deben ser determinadas, para su amplificación mediante PCR, pero, una vez hecho esto, debido a su alto nivel de polimorfismo, se pueden empelar en diferentes tipos de individuos; ya que se ha demostrado que se conservan entre diferentes poblaciones o razas de una misma especie, o incluso entre especies emparentadas como las gallinas y los pavos.
Tienen la ventaja de ser multialélicos, altamente polimórficos, con herencia mendeliana co-dominante, interpretación sencilla de los resultados, reproducibilidad muy alta, resultados transferibles entre laboratorios y posible automatización, además de obtenerse por PCR, por lo que se necesitan pequeñas cantidades de ADN. Por ello son herramientas apropiadas para el mapeo de ligamiento, identificación de QTL (quantitative trait loci), estimación de relaciones genéticas (distancias genéticas) entre diferentes poblaciones y tests de paternida; por lo tanto, se ha convertido en una técnica estándar para la evaluación molecular genética de cualquier población animal y humana.
http://artigoo.com/marcadores-de-adn-microsatelites
5.1.3.2 RAPD
La amplificación aleatoria de ADN polimórfico, más conocida por el acrónimo inglés RAPDs (Random Amplification of Polymorphic DNA), es un tipo de marcador molecular basado en la reacción en cadena de la polimerasa. Los fragmentos de ADN obtenidos por medio de esta técnica se amplifican en regiones aleatorias del genoma ya que los iniciadores o cebadores de la reacción son secuencias arbitrarias de ADN sintético. Es una de las técnicas más versátiles desde que se desarrolló en el año 1990. Es muy cómoda, rápida, requiere poco ADN que además no necesita estar muy puro, no presupone conocimientos previos sobre la secuencia, y se pueden distinguir rápida y simultáneamente muchos organismos. Sus inconvenientes son que los fragmentos amplificados no suelen corresponder a ADN ligado a algún carácter, sino redundante, y que no da información sobre el número de copias que el ADN genómico contiene de la secuencia amplificada. Esta tecnología ha sido utilizada para análisis de diversidad genética mejoramiento genético y diferenciación de líneas clonales.
5.1.3.1 AFLP
Los polimorfismos en la longitud de fragmentos amplificados, más conocidos por su acrónimo inglés AFLP ("Amplified fragment length polymorphism"), son un tipo de marcador molecular que está basado en la restricción del ADN genómico mediante enzimas de restricción y en la subsecuente amplificación de algunos de esos fragmentos mediante la reacción en cadena de la polimerasa. Son una herramienta poderosa de análisis del genoma dado que poseen un alto poder de detección de la variabilidad genética. El ensayo de AFLP combina la especificidad, resolución y poder de muestreo de la digestión con enzimas de restricción con la velocidad y practicidad de la detección de polimorfismos mediante PCR, sin necesidad de disponer de información previa del genoma a estudiar. La técnica de AFLP es propiedad de la empresa de biotecnología holandesa KeyGene.
5.1.3 Marcadores moleculares
Fragmentos específicos de ADN que pueden ser identificados en todo el genoma.
Los marcadores moleculares están situados en lugares específicos del genoma. Se usan para “marcar” la posición de un gen en concreto o la herencia de una característica particular. En un cruzamiento genético, las características de interés seguirán generalmente unidas a los marcadores moleculares. Por lo tanto, se pueden seleccionar individuos en los que el marcador molecular esté presente, ya que el marcador indica la presencia de la característica deseada.
Los marcadores moleculares están situados en lugares específicos del genoma. Se usan para “marcar” la posición de un gen en concreto o la herencia de una característica particular. En un cruzamiento genético, las características de interés seguirán generalmente unidas a los marcadores moleculares. Por lo tanto, se pueden seleccionar individuos en los que el marcador molecular esté presente, ya que el marcador indica la presencia de la característica deseada.
Fuente: GreenFacts basado en el estudio sobre Cultivos modificados genéticamente de GreenFacts
5.1.2 Northern
Northern blot es una técnica de detección de moléculas de ácido ribonucleico (ARN) de una secuencia dada dentro de una mezcla compleja (por ejemplo, un ARN mensajero para un péptido dado en una extracción de ARN total). Para ello, se toma la mezcla de ARN y se somete a una electroforesis en gel a fin de separar los fragmentos en base a su tamaño. Tras esto, se transfiere el contenido del gel, ya resuelto, a una membrana cargada positivamente en la cual se efectúa la hibridación de una sonda molecular marcada radiactiva o químicamente.
Procedimiento
El procedimiento general comienza con la extracción del RNA total de una muestra de tejido homogenizado. El mRNA se puede aislar a través del uso de cromatografía para mantener solamente los ARN con colas de poli-A. Las muestras de ARN son entonces separadas por electroforesis en gel. Dada la fragilidad de los geles y la incapacidad de las sondas para penetrar en la matriz, las muestras de RNA, separadas por tamaño tras la electroforesis, serán tranferidas a una membrana de Nailon por medio de capilaridad o un sistema de transferencia al vacío.
Geles
Las muestras de RNA son normalmente separadas en geles de agarosa que contienen formaldehído como agente desnaturalizante del RNA para obtener su estructura secundaria. Los geles pueden ser teñidos con bromuro de etidio y visualizados bajo luz ultravioleta para observar el RNA. Los geles de poliacrilamida con urea también pueden utilizarse, aunque esto suele limitarse a fragmentos de RNA o miRNA, ya que crean un tamaño de poro mas estrecho en su matriz, por lo que el RNA que suele utilizarse no podría desplazarse por el gel. Suele utilizarse además un patrón de RNA con muestras de tamaño conocido para poder extrapolar el tamaño de las muestras en estudio.
Sondas
Las sondas del northern blot están compuestas por ácidos nucleicos con una secuencia complementaria a todo o parte del RNA que nos interesa. Pueden ser de DNA, RNA o oligonucleótidos, con un mínimo de 25 bases complementarias para nuestra secuencia diana. Las sondas de RNA o ribosondas que se transcriben in vitro ayudan a prevenir el ruido de fondo. Normalmente, el DNA complementario se sintetiza con cebadores para la secuencia RNA de interés para actuar como sonda en el Northern blot. Las sondas requieren ser marcadas bien con isótopos radiactivos (32P) o con quimioluminiscencia, ya sea con fosfatasa alcalina o con peroxidasa de rábano, las cuáles, tras la adición de su sustrato específico producen una emisión de luz detectable. El marcaje por quimioluminiscencia puede hacerse de dos formas: Por un lado, la sonda puede estar unida a la enzima o bien unida a un ligando (p.ej, biotina) para la cual hay un anticuerpo (avidina o estreptavidina en este caso) está unido a la enzima que revelará el marcaje. Los Rayos X pueden detectar tanto las señales radioactivas como las quimioluminiscentes, siendo preferida por muchos investigadores la segunda, dada su mayor rapidez, sensibilidad y reducción de los riesgos para la salud que conlleva trabajar con compuestos radioactivos.
Procedimiento
El procedimiento general comienza con la extracción del RNA total de una muestra de tejido homogenizado. El mRNA se puede aislar a través del uso de cromatografía para mantener solamente los ARN con colas de poli-A. Las muestras de ARN son entonces separadas por electroforesis en gel. Dada la fragilidad de los geles y la incapacidad de las sondas para penetrar en la matriz, las muestras de RNA, separadas por tamaño tras la electroforesis, serán tranferidas a una membrana de Nailon por medio de capilaridad o un sistema de transferencia al vacío.
Geles
Las muestras de RNA son normalmente separadas en geles de agarosa que contienen formaldehído como agente desnaturalizante del RNA para obtener su estructura secundaria. Los geles pueden ser teñidos con bromuro de etidio y visualizados bajo luz ultravioleta para observar el RNA. Los geles de poliacrilamida con urea también pueden utilizarse, aunque esto suele limitarse a fragmentos de RNA o miRNA, ya que crean un tamaño de poro mas estrecho en su matriz, por lo que el RNA que suele utilizarse no podría desplazarse por el gel. Suele utilizarse además un patrón de RNA con muestras de tamaño conocido para poder extrapolar el tamaño de las muestras en estudio.
Sondas
Las sondas del northern blot están compuestas por ácidos nucleicos con una secuencia complementaria a todo o parte del RNA que nos interesa. Pueden ser de DNA, RNA o oligonucleótidos, con un mínimo de 25 bases complementarias para nuestra secuencia diana. Las sondas de RNA o ribosondas que se transcriben in vitro ayudan a prevenir el ruido de fondo. Normalmente, el DNA complementario se sintetiza con cebadores para la secuencia RNA de interés para actuar como sonda en el Northern blot. Las sondas requieren ser marcadas bien con isótopos radiactivos (32P) o con quimioluminiscencia, ya sea con fosfatasa alcalina o con peroxidasa de rábano, las cuáles, tras la adición de su sustrato específico producen una emisión de luz detectable. El marcaje por quimioluminiscencia puede hacerse de dos formas: Por un lado, la sonda puede estar unida a la enzima o bien unida a un ligando (p.ej, biotina) para la cual hay un anticuerpo (avidina o estreptavidina en este caso) está unido a la enzima que revelará el marcaje. Los Rayos X pueden detectar tanto las señales radioactivas como las quimioluminiscentes, siendo preferida por muchos investigadores la segunda, dada su mayor rapidez, sensibilidad y reducción de los riesgos para la salud que conlleva trabajar con compuestos radioactivos.
5.1.1 Southern
es un método de biología molecular que permite detectar la presencia de una secuencia de ADN en una mezcla compleja de este ácido nucleico. Para ello, emplea la técnica de electroforesis en gel de agarosa con el fin de separar los fragmentos de ADN de acuerdo a su longitud y, después, una transferencia a una membrana en la cual se efectúa la hibridación de la sond. Su nombre procede del apellido de su inventor, un biólogo inglés llamado Edwin Southern.


5.1 Tecnicas basadas en PCR y/ o electrroforesis
La reacción en cadena de la polimerasa, conocida como PCR por sus siglas en inglés (Polymerase Chain Reaction), es una técnica de biología molecular desarrollada en 1986 por Kary Mullis cuyo objetivo es obtener un gran número de copias de un fragmento de ADN particular, partiendo de un mínimo; en teoría basta partir de una única copia de ese fragmento original, o molde.
Esta técnica sirve para amplificar un fragmento de ADN; su utilidad es que tras la amplificación resulta mucho más fácil identificar con una muy alta probabilidad, virus o bacterias causantes de una enfermedad, identificar personas (cadáveres) o hacer investigación científica sobre el ADN amplificado. Estos usos derivados de la amplificación han hecho que se convierta en una técnica muy extendida, con el consiguiente abaratamiento del equipo necesario para llevarla a cabo.
Esta técnica se fundamenta en la propiedad natural de los ADN polimerasas para replicar hebras de ADN, para lo cual se emplean ciclos de altas y bajas temperaturas alternadas para separar las hebras de ADN recién formadas entre sí tras cada fase de replicación y, a continuación, dejar que vuelvan a unirse las hebras de ADN para que vuelvan a duplicarlas. La reacción en cadena de la polimerasa fue perfeccionada por Kary Mullis perteneciente a la Cetus Corporation en California SA, en la década de 1980.
Inicialmente la técnica era lenta, ya que las polimerasas se desnaturalizaban al realizar los cambios de temperatura y era necesario agregar nuevas polimerasas en cada ciclo. Puesto que las temperaturas del ciclo (95 °C en las fases de desnaturalización del ADN) suponen la inmediata desnaturalización de toda proteína, se emplean ADN polimerasas termoestables, extraídas de microorganismos adaptados a vivir a esas temperaturas, restrictivas para la mayoría de los seres vivos. Dichos microorganismos, generalmente arqueas, son: Thermus aquaticus (polimerasa Taq), furiosus (Pfu), Thermococcus litoralis (Vent) y Thermus termophilus (Tth). Generalmente se emplean mezclas de polimerasas muy procesivas (Taq) con otras capaces de hacer corrección de errores (Pfu, Vent).
Esta técnica sirve para amplificar un fragmento de ADN; su utilidad es que tras la amplificación resulta mucho más fácil identificar con una muy alta probabilidad, virus o bacterias causantes de una enfermedad, identificar personas (cadáveres) o hacer investigación científica sobre el ADN amplificado. Estos usos derivados de la amplificación han hecho que se convierta en una técnica muy extendida, con el consiguiente abaratamiento del equipo necesario para llevarla a cabo.
Esta técnica se fundamenta en la propiedad natural de los ADN polimerasas para replicar hebras de ADN, para lo cual se emplean ciclos de altas y bajas temperaturas alternadas para separar las hebras de ADN recién formadas entre sí tras cada fase de replicación y, a continuación, dejar que vuelvan a unirse las hebras de ADN para que vuelvan a duplicarlas. La reacción en cadena de la polimerasa fue perfeccionada por Kary Mullis perteneciente a la Cetus Corporation en California SA, en la década de 1980.
Inicialmente la técnica era lenta, ya que las polimerasas se desnaturalizaban al realizar los cambios de temperatura y era necesario agregar nuevas polimerasas en cada ciclo. Puesto que las temperaturas del ciclo (95 °C en las fases de desnaturalización del ADN) suponen la inmediata desnaturalización de toda proteína, se emplean ADN polimerasas termoestables, extraídas de microorganismos adaptados a vivir a esas temperaturas, restrictivas para la mayoría de los seres vivos. Dichos microorganismos, generalmente arqueas, son: Thermus aquaticus (polimerasa Taq), furiosus (Pfu), Thermococcus litoralis (Vent) y Thermus termophilus (Tth). Generalmente se emplean mezclas de polimerasas muy procesivas (Taq) con otras capaces de hacer corrección de errores (Pfu, Vent).
domingo, 9 de diciembre de 2012
4.4 Bioetica y revolucion biotegnologica
Hoy día esta disciplina que ahora conocemos como bioética ha adquirido un auge inusitado y se ha establecido firmemente como un área importante de investigaciones y de conocimiento.
La bioética además considerada como una materia esencial del curriculum de muchas universidades, tanto al nivel de pregrado como de postgrado y es un curso obligatorio en la mayoría de las escuelas de medicina y de enfermería.la bioética estudia desde una perspectiva moral un tema que nos interesa y a la vez nos preocupa a todos. Estema es el efecto impactante que ha tenido sobre nuestras vidas al desarrollo revolucionario de las ciencias biológicas y tecnológicas médicas en las últimas décadas del siglo XX.
http://www.buenastareas.com/ensayos/Bietica-y-Revolucion-Biotecnologica/4737873.html
La bioética además considerada como una materia esencial del curriculum de muchas universidades, tanto al nivel de pregrado como de postgrado y es un curso obligatorio en la mayoría de las escuelas de medicina y de enfermería.la bioética estudia desde una perspectiva moral un tema que nos interesa y a la vez nos preocupa a todos. Estema es el efecto impactante que ha tenido sobre nuestras vidas al desarrollo revolucionario de las ciencias biológicas y tecnológicas médicas en las últimas décadas del siglo XX.
http://www.buenastareas.com/ensayos/Bietica-y-Revolucion-Biotecnologica/4737873.html
4.3 Legislacion
Act. 4.3 - – Legislación europea actual e implementación de la gestión de residuos domésticos
http://www.twinning-waste-bacau.ro/twinning-1/actividades-focalizadas-gestion-de-residuos-urbanos/armonizacion-legislativa/act-4-3-2013-legislacion-europea-actual-e-implementacion-de-la-gestion-de-residuos-domesticos
Discutieron aquellos aspectos de la legislación europea en vigor relativa a gestión de residuos domésticos que mayor interés o dudas suscitaban a los expertos rumanos, basándose en las experiencias de España y Holanda. Los temas fueron los siguientes:
- Residuos de construcción y demolición provenientes de casas particulares – instrumentos y mecanismos económico-financieros para crear un sistema de recogida y puesta en valor
- Pilas y baterías portátiles – métodos para estimular a los ciudadanos a que las recojan selectivamente.
- Identificación de RAEE en la Tarifa Armonizada de Aduanas – asignación de un código aduanero. Su clasificación de acuerdo a códigos aduaneros.
- Residuos biodegradables. Esquemas de recogida. Medidas e instrumentos usados / estipulados en la legislación de estados miembros para alcanzar los objetivos de reciclaje.
- Medidas e instrumentos previstos en la legislación relativos al tratamiento de residuos domésticos antes de su vertido en un vertedero
- Temas relacionados con la transposición de algunas disposiciones de la Directiva 2008/98/EC – residuos que dejan de ser considerados como tales.
- Clausura de vertederos de residuos – que se contempla en el artículo 14 de la Directiva 1999/31/CE sobre vertido de residuos.
- Lista de residuos, criterios de clasificación; caracterización de residuos.
- Criterios de admisibilidad de residuos en vertedero – procedimientos aplicados / Presentación de alguna guía usada por operadores de vertederos.
Parte del tiempo fue asimismo dedicada a la preparación de documentación útil para los beneficiarios rumanos.http://www.twinning-waste-bacau.ro/twinning-1/actividades-focalizadas-gestion-de-residuos-urbanos/armonizacion-legislativa/act-4-3-2013-legislacion-europea-actual-e-implementacion-de-la-gestion-de-residuos-domesticos
4.2.5.2 Animales transgénicos
Los animales transgénicos son aquellos que poseen un gen que no les pertenece La forma más sencilla para generar un animal transgénico es la que involucra el aislamiento del gen que se quiere introducir (al que llamaremos transgén), su clonación y manipulación para que pueda ser expresado por el organismo blanco, y su inserción en el organismo. Para lograr que todas las células del organismo expresen este nuevo gen, incorporamos dicho gen en un embrión en estadio de cigoto. Una vez seguros que el embrión incorporó el transgén, implantamos el embrión en un animal receptivo, que actúa como madre (en un procedimiento similar al de fertilización in vitro).
http://aportes.educ.ar/biologia/nucleo-teorico/influencia-de-las-tic/manipulacion-y-reprogramacion-de-genes/animales_transgenicos.php
http://aportes.educ.ar/biologia/nucleo-teorico/influencia-de-las-tic/manipulacion-y-reprogramacion-de-genes/animales_transgenicos.php
4.2.5.1 Plantas transgénicas
La definición de una planta transgénica resulta simple pero a la vez muy compleja también, dado que cualquier elemento transgénico se trata de un ser vivo al cual se le incrustan genes de otros seres vivos. Actualmente es viable insertar genes de un organismo en cualquier otro organismo. Para varias industrias, sobretodo la agropecuaria, este método despliega una gran multitud de oportunidades enfocadas hacia el futuro..
4.2.5 Tecnología de ADN recombinante en la agricultura
Los instrumentos básicos de la investigación de genes.
En las últimas décadas la tecnología de recombinación del ADN también conocida como ingeniería genética, o más acertadamente recombinación genética in vitro, ha revolucionado la biología. El campo de la salud es uno de los más beneficiados con el desarrollo de esta tecnología. Las investigaciones que se realizan en esta área están enfocadas a un diagnóstico oportuno de enfermedades, así como su posible tratamiento a través de la terapia con moléculas recombinantes e introducción de genes. Además, la manipulación de genes proporciona una herramienta fundamental para la eliminación futura de enfermedades mortales para el hombre. Por estas razones resulta útil que el médico de asistencia esté familiarizado con conceptos básicos sobre biología molecular, su aplicación en la investigación biomédica, y en especial con sus posibles aplicaciones clínicas, conceptos estos que aparecen cada vez con mayor frecuencia en toda la literatura biomédica, tanto básica como clínica. El rápido progreso de la biotecnología y, de hecho, su propia existencia, es el resultado de utilizar unas pocas técnicas.
En las últimas décadas la tecnología de recombinación del ADN también conocida como ingeniería genética, o más acertadamente recombinación genética in vitro, ha revolucionado la biología. El campo de la salud es uno de los más beneficiados con el desarrollo de esta tecnología. Las investigaciones que se realizan en esta área están enfocadas a un diagnóstico oportuno de enfermedades, así como su posible tratamiento a través de la terapia con moléculas recombinantes e introducción de genes. Además, la manipulación de genes proporciona una herramienta fundamental para la eliminación futura de enfermedades mortales para el hombre. Por estas razones resulta útil que el médico de asistencia esté familiarizado con conceptos básicos sobre biología molecular, su aplicación en la investigación biomédica, y en especial con sus posibles aplicaciones clínicas, conceptos estos que aparecen cada vez con mayor frecuencia en toda la literatura biomédica, tanto básica como clínica. El rápido progreso de la biotecnología y, de hecho, su propia existencia, es el resultado de utilizar unas pocas técnicas.
4.2.4 Vectores de clonación
Los vectores de clonación son moléculas transportadoras que transfieren y replican fragmentos de ADN que llevan insertados mediante técnicas de ADN recombinante. Para que sirva de vector, una molécula debe ser capaz de replicarse junto con el fragmento de ADN que transporta. También tiene que tener secuencias de reconocimiento que permitan la inserción del fragmento de ADN a clonar.
Para insertar un fragmento de ADN al vector, se utiliza una enzima de restricción, y se mezcla con fragmentos de ADN producidos con la misma enzima.
Los vectores que transportan un fragmento insertado se denominan vectores recombinantes.
Tipos de vectores
Hay muchos vectores de clonación, que difieren en la especificidad de la célula huésped, el tamaño de los insertos que pueden transportar y en características como el número de copias que producen y el número y tipo de genes marcadores que contienen, entre otras.
- Es pequeño, de modo que puede transportar fragmentos de ADN relativamente grandes (de unos 10.000 pares de bases).
- Tiene un origen de replicación y puede producir hasta 500 copias de los fragmentos de ADN insertado por célula.
Para insertar un fragmento de ADN al vector, se utiliza una enzima de restricción, y se mezcla con fragmentos de ADN producidos con la misma enzima.
Los vectores que transportan un fragmento insertado se denominan vectores recombinantes.
Tipos de vectores
Hay muchos vectores de clonación, que difieren en la especificidad de la célula huésped, el tamaño de los insertos que pueden transportar y en características como el número de copias que producen y el número y tipo de genes marcadores que contienen, entre otras.
Plásmidos
Los plásmidos fueron los primeros vectores que se desarrollaron, y aún son ampliamente usados. Estos vectores proceden de moléculas de ADN de doble cadena extracromosómicas que se encuentran de manera natural y que se replican autónomamente dentro de las células bacterianas.pUC18
Es un plásmido muy utilizado, ya que presenta unas características que son muy beneficiosas:- Es pequeño, de modo que puede transportar fragmentos de ADN relativamente grandes (de unos 10.000 pares de bases).
- Tiene un origen de replicación y puede producir hasta 500 copias de los fragmentos de ADN insertado por célula.
4.2.3 Clonación de genes
Clonación de genes, el proceso mediante el cual puede aislarse un gen de entre todos los genes diferentes que existen en un organismo, lo que permite realizar su caracterización. Esto se consigue con la preparación de una batería de bacterias que contienen todos los genes distintos presentes en un organismo de manera que cada una de ellas contiene un solo gen. Esto se lleva a cabo efectuando cortes del ADN de un individuo. Otra alternativa es la de crear un conjunto de todas las secuencias de ADN expresadas en una célula específica mediante la producción de copias complementarias de ADN a partir del ARNm hallado en dichas células (v ase Biología molecular). En ambos casos, los fragmentos de ADN se unen a un vector, un virus bacteriano conocido como bacteriófago o a un ADN circular denominado plasmido, que se introduce en una bacteria de forma que cada una adquiere solo una copia del vector y por tanto recibe solo un fragmento de ADN.
Los grupos preparados de esta forma se pueden examinar para identificar la bacteria que contiene el gen objeto de estudio. Entonces, se toma esta bacteria y se hace crecer para producir un clon de bacterias idénticas. Como el vector que contiene el ADN insertado se replica siempre que la célula bacteriana se divide, se produce la cantidad suficiente de ADN insertado clonado necesaria para caracterizar el gen. De esta manera es posible estudiar los genes que codifican proteínas que tienen un interés especial, o aquellos cuya inactivación, consecuencia de una mutación, origina una enfermedad específica. Por ejemplo, podemos determinar su secuencia y la naturaleza de la mutación que da lugar a una enfermedad.
Con posterioridad, el gen se puede expresar en la célula bacteriana para producir la proteína específica que se puede emplear en el tratamiento de enfermedades como la diabetes mellitus (insulina) o el enanismo (hormona del crecimiento). Recientemente, se han podido introducir genes funcionales clonados en los individuos, para tratar una enfermedad de forma más directa. Es probable que el empleo de estos procedimientos de tratamiento genético con ADN clonado aumente en el futuro.
http://html.rincondelvago.com/clonacion_3.html
Los grupos preparados de esta forma se pueden examinar para identificar la bacteria que contiene el gen objeto de estudio. Entonces, se toma esta bacteria y se hace crecer para producir un clon de bacterias idénticas. Como el vector que contiene el ADN insertado se replica siempre que la célula bacteriana se divide, se produce la cantidad suficiente de ADN insertado clonado necesaria para caracterizar el gen. De esta manera es posible estudiar los genes que codifican proteínas que tienen un interés especial, o aquellos cuya inactivación, consecuencia de una mutación, origina una enfermedad específica. Por ejemplo, podemos determinar su secuencia y la naturaleza de la mutación que da lugar a una enfermedad.
Con posterioridad, el gen se puede expresar en la célula bacteriana para producir la proteína específica que se puede emplear en el tratamiento de enfermedades como la diabetes mellitus (insulina) o el enanismo (hormona del crecimiento). Recientemente, se han podido introducir genes funcionales clonados en los individuos, para tratar una enfermedad de forma más directa. Es probable que el empleo de estos procedimientos de tratamiento genético con ADN clonado aumente en el futuro.
http://html.rincondelvago.com/clonacion_3.html
4.2.2 Enzimas de unión
Cada célula y cada tejido tienen su actividad propia, lo que comporta continuos cambios en su estado bioquímico, en la base de la cual están las enzimas, que tienen el poder de catalizar, facilitar, y agilizar determinados procesos sintéticos y analíticos. Los propios genes son reguladores de la producción de las enzimas; por tanto, genes y enzimas pueden considerados como las unidades fundamentales de la vida.
Este concepto poco difundido casi hasta el siglo XX, se ha desarrollado y concretado cada vez mas, y constituye un componente esencial de diversas disciplinas: la microbiología, la fisiología, la bioquímica, la inmunología y la taxonomía, formando además parte del campo aplicado, en gran variedad de industrias. El rasgo particular de las enzimas es que pueden catalizar procesos químicos a baja temperatura, compatible con la propia vida, sin el empleo de sustancias lesivas para los tejidos. La vida es, en síntesis, una cadena de procesos enzimáticos, desde aquellos que tienen por sustratos los materiales mas simples, como el agua (H2O) y el anhídrido carbónico (CO2), presentes en los vegetales para la formación de hidratos de carbono, hasta los mas complicados que utilizan sustratos muy complejos.
La formación de los prótidos, los glúcidos y los lípidos es un ejemplo típico: Son a la vez degradados y reconstruidos por otras reacciones enzimáticas, produciendo energía a una velocidad adecuada para el organismo, sin el gasto energético que exigen los métodos químicos de laboratorio.
http://www.monografias.com/trabajos5/enzimo/enzimo.shtml
Este concepto poco difundido casi hasta el siglo XX, se ha desarrollado y concretado cada vez mas, y constituye un componente esencial de diversas disciplinas: la microbiología, la fisiología, la bioquímica, la inmunología y la taxonomía, formando además parte del campo aplicado, en gran variedad de industrias. El rasgo particular de las enzimas es que pueden catalizar procesos químicos a baja temperatura, compatible con la propia vida, sin el empleo de sustancias lesivas para los tejidos. La vida es, en síntesis, una cadena de procesos enzimáticos, desde aquellos que tienen por sustratos los materiales mas simples, como el agua (H2O) y el anhídrido carbónico (CO2), presentes en los vegetales para la formación de hidratos de carbono, hasta los mas complicados que utilizan sustratos muy complejos.
La formación de los prótidos, los glúcidos y los lípidos es un ejemplo típico: Son a la vez degradados y reconstruidos por otras reacciones enzimáticas, produciendo energía a una velocidad adecuada para el organismo, sin el gasto energético que exigen los métodos químicos de laboratorio.
http://www.monografias.com/trabajos5/enzimo/enzimo.shtml
4.2.1 Enzimas de corte
Las enzimas de restricción, también conocidas como endonucleasas,
son enzimas que cortan los enlaces fosfodiester del material genético a partir
de una secuencia que reconocen.
Existen 3 tipos de enzimas de restricción
Tipo I y Tipo III:
http://academic.uprm.edu/~jvelezg/EnzimasDNA.htm
Las mismas permiten cortar DNA de hebra doble, donde reconocen
secuencias palindrómicas (secuencias que se leen igual en ambas
direcciones).
Son extraídas de organismos procarióticos (bacterias), donde actúan
como un mecanismo de defensa, para degradar material genético extraño que entre
en la célula. Las bacterias tienen la
capacidad de metilar su DNA, lo cual sirve para distinguir entre el DNA extraño
y el DNA propio. Las enzimas de
restricción no pueden cortar DNA metilado, de este modo solo afectan el DNA
extranjero y no el DNA bacterial.Existen 3 tipos de enzimas de restricción
Tipo I y Tipo III:
a.
Tienen actividad de restricción (cortan) y modificación
(metilan).
b.
Cortan a cierta distancia de la secuencia de reconocimiento, las
Tipo I cortan lejos de la secuencia de reconocimiento, ya sea río arriba o río
abajo. Las Tipo III cortan de 5-8 bases
antes o despúes de la secuencia que reconocen.
c.
Necesitan ATP para moverse a través de la molécula de DNA, desde el
lugar de reconocimiento hasta el sitio del corte.
Tipo
II:
a.
Sólo tienen actividad de restricción.
b.
Cortan de manera consistente y predecible dentro de la secuencia
que reconocen.
c.
Sólo requieren Mg++ como cofactor.
d.
No necesitan ATP.
http://academic.uprm.edu/~jvelezg/EnzimasDNA.htm
4.2 Corte y union de moleculas de ADN
Corte del ADN en
fragmentos pequeños y manejables mediante la utilización de un tipo de enzimas
conocidas como enzimas de restricción que pueden
considerarse como las "tijeras moleculares". Estas enzimas se aislaron en
bacterias y se identifican con distintos nombres, siendo lo característico de
ellas estos dos principios:
- Cada enzima de restricción reconoce una secuencia específica de nucleótidos y corta en ese punto cada una de las cadenas de ADN.
- Los extremos libres que quedan se llaman extremos pegajosos, porque pueden unirse a otros fragmentos de ADN que hayan sido cortados por la misma enzima de restricción.
4.1 Transformacion de organismos
La nutrición celular exige que el organismo sea eficaz en la ingestión de las sustancias nutrientes, en su transformación para que lleguen en condiciones de atravesar las membranas celulares (digestión, respiración) y en el transporte o circulación de dichas sustancias hasta las células.
Una vez en el interior de la célula, los nutrientes sufren todo un conjunto de reacciones químicas que recibe el nombre de metabolismo. Los nutrientes, en el lenguaje biológico, incluyen no solamente los alimentos y el agua, sino también el oxígeno, el dióxido de carbono y la energía luminosa y química.
En el mundo vivo se distinguen tres procesos principales de transformación de energía:
· En la fotosíntesis la energía radiante del sol se transforma en energía química, que queda almacenada en los enlaces de los carbohidratos y otras moléculas complejas sintetizados.
· Mediante la respiración celular, esta energía pasa a una nueva forma: los enlaces fosfato producidos en la degradación escalonada de la glucosa y otras moléculas
· El trabajo celular se produce cuando la energía química de los enlaces fosfato es utilizada por la célula para realizar trabajo. Este trabajo puede ser muscular (contracción muscular), eléctrico (impulsos nerviosos), osmótico (transporte de moléculas en contra de un gradiente de concentración) o químico (síntesis de nuevas moléculas para el crecimiento de la célula o el almacenamiento de energía).
http://benitobios.blogspot.mx/2009/03/transformacion-de-la-energia-en-los.html
Una vez en el interior de la célula, los nutrientes sufren todo un conjunto de reacciones químicas que recibe el nombre de metabolismo. Los nutrientes, en el lenguaje biológico, incluyen no solamente los alimentos y el agua, sino también el oxígeno, el dióxido de carbono y la energía luminosa y química.
En el mundo vivo se distinguen tres procesos principales de transformación de energía:
· En la fotosíntesis la energía radiante del sol se transforma en energía química, que queda almacenada en los enlaces de los carbohidratos y otras moléculas complejas sintetizados.
· Mediante la respiración celular, esta energía pasa a una nueva forma: los enlaces fosfato producidos en la degradación escalonada de la glucosa y otras moléculas
· El trabajo celular se produce cuando la energía química de los enlaces fosfato es utilizada por la célula para realizar trabajo. Este trabajo puede ser muscular (contracción muscular), eléctrico (impulsos nerviosos), osmótico (transporte de moléculas en contra de un gradiente de concentración) o químico (síntesis de nuevas moléculas para el crecimiento de la célula o el almacenamiento de energía).
http://benitobios.blogspot.mx/2009/03/transformacion-de-la-energia-en-los.html
martes, 27 de noviembre de 2012
3.5.2.3 Cryoconservación del germoplasma
crioconservación, que describimos a continuación, puede ser aplicada
ventajosamente a la conservación de especies y variedades vegetales silvestres o
cultivadas como alternativa a las colecciones y bancos de germoplasma clásicos
(bancos de semillas, colecciones en campo). La crioconservación de plantas es un
proceso consistente en la preparación, mantenimiento y preservación a largo
plazo de un material vegetal, en unas condiciones de temperatura ultra bajas de
–196 ºC, obtenidas mediante nitrógeno líquido (NL). Este método de conservación
de material vegetal presenta una serie de ventajas frente a otros sistemas de
preservación de recursos filogenéticos: es un método rápido, sencillo, no altera
la estabilidad genética del material y reduce sustancialmente el esfuerzo y los
costes que representan el mantenimiento de colecciones de germoplasma vegetal
in vivo o in vitro, al eliminar casi por completo la mano de obra
y evitar los riesgos fitopatológicos y fisiológicos que habitualmente aparecen
en el mantenimiento de los bancos de germoplasma vegetales. Hay que señalar el
importante ahorro de espacio que supone mantener una colección de especies
hortícolas o leñosas en pocos metros cuadrados en vez de en plantaciones de
cientos o miles de metros cuadrados.
El elemento fundamental de la
crioconservación es el NL que se almacena y mantiene en tanques especiales
herméticos que permiten que se mantenga en estado líquido y se evapore muy
lentamente, manteniendo una temperatura de –196 ºC. El NL es incoloro, inodoro y
no combustible y está a una temperatura de –196 ºC a presión atmosférica, por lo
que el contacto con los tejidos provoca el congelamiento del área. Es de fácil
manejo pero, teniendo en cuenta que desplaza el oxígeno del aire, hay que tener
cuidado al manipularlo, lo que se debe hacer en lugares bien ventilados.
3.5.2.2 Supresión del crecimiento
-Única opción viable para almacenamiento a largo plazo en especies de propagación vegetativa o semilla recalcitrante.
-se requiere muy poco espacio y mantenimiento.
-Está protegido de la contaminación.
-Dependiendo de la especie, cualquier tipo de material.
-Protocolos de regeneración.
3.5.2.1 Factores que limitan el crecimiento
LO QUE INHIBE LA REPRODUCCION DE LAS BACTERIAS, SON LOS FACTORES CLIMATICOS (MUCHO FRIO, O MUCHO CALOR LAS MATAN).
FALTA DE MATERIAL ORGANICO DEL CUAL ALIMENTARSE.
FALTA DE AGUA DEL CUAL NUTRIRSE.
PERO COMO SIEMPRE HABRA MATERIAL ORGANICO Y AGUA, ES CASI IMPOSIBLE EVITAR QUE LAS BACTERIAS HABITEN LA TIERRA
FALTA DE MATERIAL ORGANICO DEL CUAL ALIMENTARSE.
FALTA DE AGUA DEL CUAL NUTRIRSE.
PERO COMO SIEMPRE HABRA MATERIAL ORGANICO Y AGUA, ES CASI IMPOSIBLE EVITAR QUE LAS BACTERIAS HABITEN LA TIERRA
3.5.2 Métodos de conservación
En cualquier laboratorio de microbiología es fundamental el mantenimiento y conservación de las colecciones de microorganismos con las que trabajamos ya que, obviamente, son nuestro reactivo primordial. Existen una gran variedad de métodos de mantenimiento y conservación de los microorganismos cuya utilización va a depender en parte del tiempo previsto
(Mantenimiento---->Cortos períodos de tiempo, días;
Conservación ----> Largos períodos de tiempo, años) y en parte de las características de los diferentes microorganismos (bacterias, hongos, virus, algas, protozoos).
Los objetivos de las colecciones de los microorganismos son muy simples:
1.- Mantener los cultivos viables a lo largo del tiempo.
2.- Mantener los cultivos puros, sin contaminaciones.
3.- Mantener los cultivos sin cambios en sus características, es decir estables.
http://darwin.usal.es/profesores/pfmg/sefin/MI/tema04MI.html
3.5.1.4 Estrategias
La conservación de la biodiversidad constituye un objetivo prioritario
en un escenario en que las relaciones entre el desarrollo tecnológico y la
conservación del ambiente ocupan crecientemente el debate público. En
particular, la conservación de los recursos fitogenéticos de interés para la
agricultura es un factor ampliamente reconocido para contribuir al desarrollo
sostenible de la misma y a la conservación de los recursos naturales. Uno de
los ventajas más destacables del cultivo de tejidos in vitro es su
posibilidad de propagar a gran escala cualquier material vegetal con mínimo
riesgo de introducir o reintroducir patógenos y con alto grado de estabilidad
genotípica. Por esta razón, han encontrado sus aplicaciones en la conservación
e intercambio de recursos fitogenéticos se ha incrementado aceleradamente.
Tradicionalmente, la conservación de recursos fitogenéticos se ha basado
en dos metodologías: ex situ e in situ. La conservación ex
situ incluye al cultivo de células y/o tejidos vegetales (bancos de
germoplasma in vitro). Los métodos de conservación in situ
contemplan la preservación de las especies de interés en su hábitat natural. La
criopreservación consiste en la conservación a temperaturas ultra bajas
(-196°C) en un medio criogénico como el nitrógeno líquido. Durante las últimas
décadas se ha avanzado mucho en el estudio de la respuesta del material vegetal
a bajas temperaturas. Como parte de ello, se han estudiado los procesos
fisiológicos y bioquímicos involucrados en la criopreservación y se han
investigado las condiciones que posibilitan la preservación de la viabilidad
del material vegetal almacenado por este método.
3.5.1.3 Estabilidad genética
La
estabilidad genética de los cultivos durante mucho tiempo ha sido un motivo de
inquietud cuando se piensa aplicar las técnicas in vitro para la conservación
del germoplasma.
3.5.1.2 Variabilidad
La variabilidad se refiere a la variación en el material genético de una población o especie e incluye los genomas. Para que la selección natural pueda actuar sobre un carácter, debe haber algo que seleccionar, es decir, varios alelos para el gen que codifica ese carácter. Además, cuanta más variación haya, más evolución hay. R.A. Fisher demostró matemáticamente que cuantos más alelos existan para un gen, más probabilidad hay de que uno de ellos se imponga al resto (se fije). Esto implica que cuanta más variabilidad genética exista en una población, mayor será el ritmo de la evolución.
3.5.1.1 Regeneración
La regeneración es la reactivación del desarrollo para restaurar tejidos faltantes.
El proceso de regeneración puede ocurrir en múltiples niveles de la organización biológica y la habilidad de los diferentes organismos para regenerar partes faltantes es altamente variable, sin embargo la capacidad de regenerar al menos alguna estructura es común en todos los phyla animales. La regeneración puede darse entonces a nivel celular, de tejido, de órgano, estructura e incluso del cuerpo entero pero en algunos organismos no se da o es altamente limitada. El proceso de regeneración de extremidades faltantes se ha observado en múltiples organismos, salamandras, cangrejos y estrellas de mar entre otros y la regeneración de individuos enteros a partir de pequeños fragmentos se ha observado en planarias y varios cnidarios.Por otro lado hay organismos como las aves y los nemátodos que son prácticamente incapaces de cualquier tipo de regeneración.
El proceso de regeneración puede ocurrir en múltiples niveles de la organización biológica y la habilidad de los diferentes organismos para regenerar partes faltantes es altamente variable, sin embargo la capacidad de regenerar al menos alguna estructura es común en todos los phyla animales. La regeneración puede darse entonces a nivel celular, de tejido, de órgano, estructura e incluso del cuerpo entero pero en algunos organismos no se da o es altamente limitada. El proceso de regeneración de extremidades faltantes se ha observado en múltiples organismos, salamandras, cangrejos y estrellas de mar entre otros y la regeneración de individuos enteros a partir de pequeños fragmentos se ha observado en planarias y varios cnidarios.Por otro lado hay organismos como las aves y los nemátodos que son prácticamente incapaces de cualquier tipo de regeneración.
3.5.1 Aspectos importantes en la conservación in vitro
_Temperatura
_Concentración de nutrientes
_Uso de reguladores de crecimiento
_Concentracion osmotica
_Evaluacion del material conservado in vitro
http://books.google.com.mx/books?id=8w2iY5avRu0C&pg=PT32&lpg=PT32&dq=Aspectos+importantes+en+la+conservaci%C3%B3n+in+vitro&source=bl&ots=V8APpTxlN7&sig=SwoiGYsWHlgf366cOzX99GuakNM&hl=es&sa=X&ei=OKO1UMvXNeSUiALH2IGgBw&ved=0CIgBEOgBMAk
_Concentración de nutrientes
_Uso de reguladores de crecimiento
_Concentracion osmotica
_Evaluacion del material conservado in vitro
http://books.google.com.mx/books?id=8w2iY5avRu0C&pg=PT32&lpg=PT32&dq=Aspectos+importantes+en+la+conservaci%C3%B3n+in+vitro&source=bl&ots=V8APpTxlN7&sig=SwoiGYsWHlgf366cOzX99GuakNM&hl=es&sa=X&ei=OKO1UMvXNeSUiALH2IGgBw&ved=0CIgBEOgBMAk
3.5 Conservacion in vitro
La metodología in vitro puede ser utilizada para conservar
germoplasma. El método es eficiente, permite conservar el material en espacios
pequeños y de fácil acceso para su posterior multiplicación y utilización. Para
el caso específico del género Musa, la conservación in vitro se presenta como
una posibilidad promisoria. Empero, la investigación básica sobre este tema es
muy escasa. En el presente trabajo se revisa la información al
respecto.
http://orton.catie.ac.cr/cgi-bin/wxis.exe/?IsisScript=UPEB.xis&method=post&formato=2&cantidad=1&expresion=mfn=005898
http://orton.catie.ac.cr/cgi-bin/wxis.exe/?IsisScript=UPEB.xis&method=post&formato=2&cantidad=1&expresion=mfn=005898
3.4.4 Aplicación agronómica
La fusión de protoplastos es una técnica de biotecnología en la cual se produce la fusión de las membranas de dos o más células dando lugar a un híbrido somático. La técnica es ampliamente empleada para introducir variabilidad en las cepas de interés biotecnológico. Típicamente se realiza mediante protoplastos vegetales, esto es, células vegetales desprovistas de pared celular, si bien también puede efectuarse empleando otros taxones, como algunos hongos.
3.4.3 Fusión de protoplastos
La técnica de fusión de protoplastos surge como especialidad o aplicación a
partir de las técnicas de aislamiento y cultivo de protoplastos, que permiten la
obtención de células desprovistas de pared celular gracias a la acción de
enzimas líticos (celulasas, pectinasas) obtenidos de microorganismos
(Aspergillus sp.; Trichoderma viride; Rhizopus sp.), y su
posterior crecimiento (división celular, formación de microcallos y regeneración
de plántulas por vía organogénica o embriogénica).
Aunque circunstancialmente ocurren fusiones espóntaneas entre protoplastos, y en este hecho se encuentra el origen de esta técnica, es necesario aumentar la eficacia del proceso y «dirigirlo» mediante sistemas de inducción adecuados. Los procesos de inducción son de dos tipos: Químicos, en ellos se usan sustancias aglutinantes como el polietilenglicol (PEG) o el dimetilsulfóxido (DMSO) y, Físicos, como la electrofusión, que consiste en la inducción de una dipolarización de los protoplastos mediante corrientes alternas de alta frecuencia, que van a hacer contactar y alinearse a los protoplastos siguiendo las líneas del campo eléctrico generado, y en ese momento con un pulso de corriente continua se consigue la fusión de las células.
La población de células resultantes de estos procesos de fusión va a ser una mezcla de protoplastos parentales, homocariontes y heterocariontes con dos o mas núcleos.
Para seleccionar los productos de fusión de interés, es necesario utilizar medios restrictivos para células no híbridas, o que produzcan una proliferación diferencial para las células híbridas y/o incorporar un sistema de marcaje que permita reconocer y seleccionar los productos híbridos. Un tipo de selección clásico es el basado en la complementación de mutantes no alélicos (por ejemplo la combinación de dos mutaciones recesivas albinas no alélicas que permiten la detección de los híbridos simplemente por su color; Melchers y Labib, 1974), existiendo otros muchos métodos de selección (incorporación de mutaciones de deficiencia, de resistencia, etc.) y tambien métodos de verificación del caracter híbrido en plántulas regeneradas, como el examen de los patrones morfológicos y/o isoenzimáticos.
http://www.encuentros.uma.es/encuentros35/protofus35.html
Aunque circunstancialmente ocurren fusiones espóntaneas entre protoplastos, y en este hecho se encuentra el origen de esta técnica, es necesario aumentar la eficacia del proceso y «dirigirlo» mediante sistemas de inducción adecuados. Los procesos de inducción son de dos tipos: Químicos, en ellos se usan sustancias aglutinantes como el polietilenglicol (PEG) o el dimetilsulfóxido (DMSO) y, Físicos, como la electrofusión, que consiste en la inducción de una dipolarización de los protoplastos mediante corrientes alternas de alta frecuencia, que van a hacer contactar y alinearse a los protoplastos siguiendo las líneas del campo eléctrico generado, y en ese momento con un pulso de corriente continua se consigue la fusión de las células.
La población de células resultantes de estos procesos de fusión va a ser una mezcla de protoplastos parentales, homocariontes y heterocariontes con dos o mas núcleos.
Para seleccionar los productos de fusión de interés, es necesario utilizar medios restrictivos para células no híbridas, o que produzcan una proliferación diferencial para las células híbridas y/o incorporar un sistema de marcaje que permita reconocer y seleccionar los productos híbridos. Un tipo de selección clásico es el basado en la complementación de mutantes no alélicos (por ejemplo la combinación de dos mutaciones recesivas albinas no alélicas que permiten la detección de los híbridos simplemente por su color; Melchers y Labib, 1974), existiendo otros muchos métodos de selección (incorporación de mutaciones de deficiencia, de resistencia, etc.) y tambien métodos de verificación del caracter híbrido en plántulas regeneradas, como el examen de los patrones morfológicos y/o isoenzimáticos.
http://www.encuentros.uma.es/encuentros35/protofus35.html
3.4.2 Variación somaclonal
El cultivo in vitro puede células vegetales un muy estresante e involucra procesos
mutagénicos durante el establecimiento del explante, la inducción de callo, la
de embriones y la regeneración de plantas.
Por esta vía es posible obtener variación, de origen nuclear y/o citoplasmática,
que podría ser utilizada para el mejoramiento vegetal. Este proceso, se denomina
Variación Somaclonal (Larkin y Scowcroft, 1981), involucra cambios en las
plantas regeneradas que son transmitidos a la progenie.
Entre las causas que original la variación somaclonal se encuentran alteraciones en el cariotipo, mutaciones puntuales, recombinación somática e intercambio de cromátidas hermanas, rearreglos génicos somáticos, elementos genéticos transponibles, amplificación y/o metilación del ADN y cambios en el ADN de los orgánelos (mitocondrias y cloroplastos).
http://www.taringa.net/posts/ciencia-educacion/7290696/Variacion-Somaclonal-_Biotecnologia-Vegetal_.html
Entre las causas que original la variación somaclonal se encuentran alteraciones en el cariotipo, mutaciones puntuales, recombinación somática e intercambio de cromátidas hermanas, rearreglos génicos somáticos, elementos genéticos transponibles, amplificación y/o metilación del ADN y cambios en el ADN de los orgánelos (mitocondrias y cloroplastos).
http://www.taringa.net/posts/ciencia-educacion/7290696/Variacion-Somaclonal-_Biotecnologia-Vegetal_.html
3.4.1 Producción de haploides: cultivo de anteras y óvulos
anteras
Mediante esta técnica, las anteras inmaduras que contienen polen en una etapa específica de desarrollo se colocan en medios donde el polen inmaduro se divide para formar embriones o callos. Transferidos estos a medios de regeneración, se forman plantas. En la mayoría de los casos se producen plantas haploides estériles, pero en algunas especies ocurre una duplicación espontanea de los cromosomas en las etapas de desarrollo del callo y regeneración de la planta.
ovulos
Mediante esta técnica, las anteras inmaduras que contienen polen en una etapa específica de desarrollo se colocan en medios donde el polen inmaduro se divide para formar embriones o callos. Transferidos estos a medios de regeneración, se forman plantas. En la mayoría de los casos se producen plantas haploides estériles, pero en algunas especies ocurre una duplicación espontanea de los cromosomas en las etapas de desarrollo del callo y regeneración de la planta.
ovulos
El cultivo de óvulos es una
técnica que se ha empleado tradicionalmente para evitar barreras de
incompatibilidad que dificultan algunos cruces inter e intraespecíficos, para
eludir problemas de abscisión prematura del fruto, para la obtención de híbridos
que presentan aborto del embrión en estadios tempranos del desarrollo, como vía
alternativa a la androgénesis en la obtención de plantas haploides o como
sistema experimental para el estudio de la respuesta in vitro de zigotos
y proembriones.
Los
primeros intentos de aislar óvulos fecundados y cultivarlos en condiciones
asépticas fueron llevados a cabo por White en 1932 con Antirrhinum majus; sin
embargo, la técnica fue desarrollada y perfeccionada en el Departamento de
Botánica de la Universidad de Delhi. Ya en 1960 Kanta desarrolló con éxito una
técnica de polinización directa del ovario. Para ello, aisló un ovario inmaduro
lo cultivó in vitro, lo perforó e introdujo en la cavidad ovarica polen
sin germinar.
3.4 Tecnicas in vitro aplicadas al fitomejoramiento
Normalmente en la producción
de haploides se trabaja con la antera en su totalidad, no con granos de polen en
particular. De una yema de flor se coge
una antera antes de que se abra y se hace un cultivo; bien por embriogénesis u
organogénesis.
Embriogénesis: se forman
células (poliembriones).
Organogénesis: se forma una
estructura de callo que puede venir o bien de tejidos de la antera (diploide), o
bien del grano de polen (haploide).
Mediante esta técnica, las
anteras inmaduras que contienen polen en una etapa específica de desarrollo se
colocan en medios donde el polen inmaduro se divide para formar embriones o
callos. Transferidos estos a medios de
regeneración, se forman plantas. En la mayoría de los casos se producen plantas
haploides estériles, pero en algunas especies ocurre una duplicación espontanea
de los cromosomas en las etapas de desarrollo del callo y regeneración de la
planta.
3.3.7 Aplicación agronómica
En la micropropagación, a partir de un fragmento (explanto) de una planta seleccionada (llamada planta madre), se obtiene una descendencia uniforme, con plantas genéticamente idénticas, denominadas clones. El explanto más usado para los procesos de propagación in vitro son las yemas vegetativas de las plantas. Los frascos que contienen las plantas se ubican en estanterías con luz artificial dentro de la cámara de crecimiento, donde se fija la temperatura en valores que oscilan entre los 21 y 23 °C, además de controlar la cantidad de horas de luz. Por su parte, el medio de cultivo se compone de una mezcla de sales minerales, vitaminas y reguladores de crecimiento, azúcar, agua y agar. La composición del medio depende de la especie vegetal y de la etapa del proceso de micropropagación.
cultivos-in-vitro-libres-de-patogenos
cultivos-in-vitro-libres-de-patogenos
3.3.6 Factores que ayudan a incrementar la posibilidad de obtener plantas libres de patógenos
Mediante este proyecto se pretende obtener material vegetal libre de patógenos, para lo que se empleará la propagación de plantas sanas mediante el cultivo in vitro de meristemos apicales de vides seleccionadas previamente, con grandes aptitudes enológicas y agronómicas.
Con esta técnica, se plantea una alternativa en la mejora vegetal del viñedo de la bodega y se asegura una sanidad total del material que se maneja en la misma, lo que propicia una selección y mantenimiento de los clones que mejor se adapten a las condiciones del entorno y que proporcionen unas características singulares propias de los terruños de la empresa.
En esta línea de trabajo y durante un período de tres años el Instituto de la Viña y el Vino de la Universidad de León procederá a la obtención de material vegetal libre de agentes patógenos y su propagación en condiciones controladas de cultivo para, en una segunda fase, aclimatarlas a las condiciones del campo.
http://urbinavinos.blogspot.mx/2011/08/cultivos-in-vitro-libres-de-patogenos.html
3.3.5 Micro injerto
Trabajando en condiciones de esterilidad, la plántula patrón se extrae del tubo de ensayo, se decapita dejando aproximadamente 1,5 cm del epicotilo, se acorta la raíz hasta 4-6 cm y se eliminan los cotiledones junto con sus yemas axilares. Aunque se han ensayado diversas formas de injerto, se utiliza mayormente la incisión T invertida con dimensiones de 1 mm en el extremo del epicotilo decapitado, a través de la corteza hasta el cambium, con cuidado de no dañar la médula.
Con el empleo de instrumentos de microdisección , se aisla el ápice caulinar menor de 0,2 mm compuesto solo por el meristemo apical más los dos o tres subyacentes primordios foliares y se coloca con la superficie de corte basal en contacto con la superficie cortical horizontal de la incisión T invertida practicada en el patrón.
Los cortes para la preparación del patrón y el aislamiento del ápice deben ser tan perfectos como sea factible y las operaciones del microinjerto deben efectuarse con la máxima rapidez posible para evitar la desecación de los tejidos.
Se ha demostrado que aunque se logra mayor prendimiento del microinjerto con el empleo de ápices caulinares mayores, existe una relación inversa entre el tamaño de estos y el porcentaje de plantas sanas obtenidas.
Además del tamaño del ápice, otros factores influyen decisivamente en el prendimiento del microinjerto como son el patrón escogido, la variedad del ápice microinjertado, la utilización de patrones etiolados, la edad de las plántulas patrón y la destreza manual del operador.
http://www.ecured.cu/index.php/Microinjerto_de_%C3%A1pices_caulinares_in_vitro
Con el empleo de instrumentos de microdisección , se aisla el ápice caulinar menor de 0,2 mm compuesto solo por el meristemo apical más los dos o tres subyacentes primordios foliares y se coloca con la superficie de corte basal en contacto con la superficie cortical horizontal de la incisión T invertida practicada en el patrón.
Los cortes para la preparación del patrón y el aislamiento del ápice deben ser tan perfectos como sea factible y las operaciones del microinjerto deben efectuarse con la máxima rapidez posible para evitar la desecación de los tejidos.
Se ha demostrado que aunque se logra mayor prendimiento del microinjerto con el empleo de ápices caulinares mayores, existe una relación inversa entre el tamaño de estos y el porcentaje de plantas sanas obtenidas.
Además del tamaño del ápice, otros factores influyen decisivamente en el prendimiento del microinjerto como son el patrón escogido, la variedad del ápice microinjertado, la utilización de patrones etiolados, la edad de las plántulas patrón y la destreza manual del operador.
http://www.ecured.cu/index.php/Microinjerto_de_%C3%A1pices_caulinares_in_vitro
3.3.4 Cultivo de embriones
El cultivo de los embriones se lleva a cabo en el laboratorio de FIV, donde se controlan y optimizan los parámetros necesarios (temperatura, pH, humedad, esterilidad...) para conseguir el desarrollo normal de los mismos.
El objetivo, a lo largo de todo el proceso, es supervisar, evaluar y seleccionar aquellos embriones que por sus características morfológicas ofrezcan una mayor garantía de implantación en el útero materno.
Para ello los embriones son cultivados en diferentes medios secuenciales que aportan de forma continua los nutrientes necesarios en cada estadio del desarrollo embrionario.
El objetivo, a lo largo de todo el proceso, es supervisar, evaluar y seleccionar aquellos embriones que por sus características morfológicas ofrezcan una mayor garantía de implantación en el útero materno.
Para ello los embriones son cultivados en diferentes medios secuenciales que aportan de forma continua los nutrientes necesarios en cada estadio del desarrollo embrionario.
En la fecundación in Vitro convencional y en la ICSI el cultivo de los embriones es imprescindible.
El óvulo fertilizado se transforma en un embrión. Se observa la evolución de todos los embriones para determinar la calidad embrionaria y decidir los mejores embriones para realizar la transferencia de embriones.
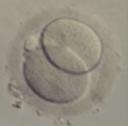
http://ovodonacion.foroes.biz/t2377-cultivo-de-embriones
3.3.3 Cultivo de ápices meristematicos
Propagación "in vitro" de variedades de Solanum tuberosum como método para la obtención de plantas libres de virus.
http://www.ciens.ucv.ve/biotecnologia/documents/cultivosap.html
http://www.ciens.ucv.ve/biotecnologia/documents/cultivosap.html
3.3.2 Cultivo de meristemos apicales
Morfogénesis en el Meristemo Apical. Multiplicación masiva de vegetales.
Recuperación de plantas libres de patógenos. Termoterapia. Quimioterapia.
plantas libres de patógenos. Termoterapia. Quimioterapia.
http://www.emagister.com/biotecnologia-vegetal-aplicaciones-del-cultivo-meristemas-apicales-tallo-cursos-302598.htm
http://www.emagister.com/biotecnologia-vegetal-aplicaciones-del-cultivo-meristemas-apicales-tallo-cursos-302598.htm
3.3.1 Descripción e importancia
El cultivo de meristemas in vitro permite, en gran cantidad de
casos, el establecimiento de cultivos libres de patógenos. Una vez confirmada
la sanidad de las plantas bajo cultivo, resulta indispensable monitorear
regularmente esta condición.
3.3.1 Descripción e importancia
El cultivo de meristemas in vitro permite, en gran cantidad de
casos, el establecimiento de cultivos libres de patógenos. Una vez confirmada
la sanidad de las plantas bajo cultivo, resulta indispensable monitorear
regularmente esta condición.
3.3 Plantas libres de patogenos
La tecnología para la obtención de plantas libres de patógenos es de gran utilidad para obtener altos rendimientos en cultivos de propagación vegetativa. El proceso pasa por dos etapas bien definidas, la primera es la etapa de laboratorio y la segunda es la etapa de invernadero. Ambas están estrechamente relacionadas, ya que para poder propagar plantas en invernaderos se debe contar con material procedente de cultivo de tejidos de laboratorio.
La propagación en invernaderos se caracteriza por que la propagación de las plantas que se instalan se realiza en un ambiente protegido del ingreso de insectos vectores trasmisores de virus, además de otras plagas. De igual modo el uso de sustrato desinfectado permite una propagación libre de patógenos y el uso de plántulas libres de virus procedentes de propagación ‘in vitro’.
3.2.4 Aplicación agronómica
Es de una importancia capital para
la subsistencia, evolución y economía humanas el poder generar suficientes
satisfactores que sostengan su existencia . Dado que la cadena alimenticia
inicia en los organismos autótrofos, es de una gran relevancia la producción de
estos. El Cultivo de Tejidos Vegetales es, desde muchos puntos de vista, una
tecnología sustentable que representa una buena respuesta a muchos problemas de
suministro de alimentos y de materias primas para la industria y consumo
humanos.
La base gracias a la cual podemos hacer este tipo de cultivos es una propiedad de las células vegetales conocida como totipotencia, esta propiedad se define como la capacidad de cualquier célula de generar un organismo completa bajo condiciones adecuadas. Esto nos permite una gran diversidad en los tejidos que queramos producir bajo condiciones de laboratorio.
http://apuntesdebioquimica.tripod.com/botanica/id2.html
3.2.3 Rutas: Organogénesis y embriogénesis somática
Organogénesis
Es el conjunto de cambios que permiten que las capas embrionarias, se transformen en los diferentes órganos que conforman un organismo.
embriogénesis somática
La embriogénesis somática es una técnica biotecnológica de propagación de plantas que permite obtener embrioides a partir de células somáticas (no sexuales) desde cualquier tipo de tejido.
http://www2.udec.cl/panorama/p485/p16.htm
3.2.2 tejidos empleados
_Tejidos embrionarios
_Tejido meristemático primario
_Tejido meristemático secundario
_Tejidos adultos:
_Tejido parenquimático
_ Tejido de sostén
_Tejido secretor
_Tejido protector
_Tejidos Conductores
http://mx.ask.com/web?qsrc=6&q=Tipos+De+Tejidos+Vegetales&o=3349&l=sem
_Tejido meristemático primario
_Tejido meristemático secundario
_Tejidos adultos:
_Tejido parenquimático
_ Tejido de sostén
_Tejido secretor
_Tejido protector
_Tejidos Conductores
http://mx.ask.com/web?qsrc=6&q=Tipos+De+Tejidos+Vegetales&o=3349&l=sem
martes, 20 de noviembre de 2012
3.2.1 Descripción e importancia
Cada tipo de planta requiere su tipo de propagación más adecuado desde el más natural y conocido como es por medio de las semillas o por división de raíces por ejemplo.
Por lo general se suelen propagar por esquejes y división de raíces plantas perennes o arbustivas y por semillas las anuales y bianuales. Conozcamos los métodos de propagación de las plantas
Este es el método más importante para propagar arbustos ornamentales. Las estacas también se usan ampliamente en la propagación comercial en invernadero de muchas plantas con flores de ornato y se usa en forma común para propagar diversas especies de frutales.
http://www.ecured.cu/index.php/Propagaci%C3%B3n_de_las_plantas
Por lo general se suelen propagar por esquejes y división de raíces plantas perennes o arbustivas y por semillas las anuales y bianuales. Conozcamos los métodos de propagación de las plantas
Este es el método más importante para propagar arbustos ornamentales. Las estacas también se usan ampliamente en la propagación comercial en invernadero de muchas plantas con flores de ornato y se usa en forma común para propagar diversas especies de frutales.
http://www.ecured.cu/index.php/Propagaci%C3%B3n_de_las_plantas
3.1 Generalidades
3.2 Micropropagacion
En la micropropagación, a partir de un fragmento (explanto) de una planta seleccionada (llamada planta madre), se obtiene una descendencia uniforme, con plantas genéticamente idénticas, denominadas clones. El explanto más usado para los procesos de propagación in vitro son las yemas vegetativas de las plantas. Los frascos que contienen las plantas se ubican en estanterías con luz artificial dentro de la cámara de crecimiento, donde se fija la temperatura en valores que oscilan entre los 21 y 23 °C, además de controlar la cantidad de horas de luz. Por su parte, el medio de cultivo se compone de una mezcla de sales minerales, vitaminas y reguladores de crecimiento, azúcar, agua y agar. La composición del medio depende de la especie vegetal y de la etapa del proceso de micropropagación.
Micropropagación es el conjunto de técnicas y métodos de cultivo de tejidos utilizados para multiplicar plantas asexualmente en forma rápida, eficiente y en grandes cantidades La micropropagación se utiliza para multiplicar o propagar plantas nuevas, tales como aquellas creadas por ingeniería genética, mutagénesis o mejoramiento genético. Se utiliza también la micropropagacion para obtener plantas libres de enfermedades (tales como virosis) u obtener grandes cantidades de plantas que no se propagan eficientemente.
http://es.wikipedia.org/wiki/Micropropagaci%C3%B3n
En la micropropagación, a partir de un fragmento (explanto) de una planta seleccionada (llamada planta madre), se obtiene una descendencia uniforme, con plantas genéticamente idénticas, denominadas clones. El explanto más usado para los procesos de propagación in vitro son las yemas vegetativas de las plantas. Los frascos que contienen las plantas se ubican en estanterías con luz artificial dentro de la cámara de crecimiento, donde se fija la temperatura en valores que oscilan entre los 21 y 23 °C, además de controlar la cantidad de horas de luz. Por su parte, el medio de cultivo se compone de una mezcla de sales minerales, vitaminas y reguladores de crecimiento, azúcar, agua y agar. La composición del medio depende de la especie vegetal y de la etapa del proceso de micropropagación.
Micropropagación es el conjunto de técnicas y métodos de cultivo de tejidos utilizados para multiplicar plantas asexualmente en forma rápida, eficiente y en grandes cantidades La micropropagación se utiliza para multiplicar o propagar plantas nuevas, tales como aquellas creadas por ingeniería genética, mutagénesis o mejoramiento genético. Se utiliza también la micropropagacion para obtener plantas libres de enfermedades (tales como virosis) u obtener grandes cantidades de plantas que no se propagan eficientemente.
http://es.wikipedia.org/wiki/Micropropagaci%C3%B3n
martes, 30 de octubre de 2012
2.3.7.4 Manejo del material transplantado
Debe prestarse atención especial al realizar el trasplante durante periodos estresantes para reducir daños a la planta, en especial al sistema de raíces o cepellón. El daño a las raíces reduce las posibilidades de éxito en el establecimiento de la planta, particularmente en melones, pepinos y calabacita. Se recomienda impartir capacitación al equipo que realice el trasplante para minimizar el daño a las plántulas. Si resulta difícil extraer las plantas de las charolas y sus raíces no están intactas, las plantas no sobrevivirán condiciones meteorológicas adversas.
http://www.hortalizas.com/articulo/14855/shock-del-trasplante
http://www.hortalizas.com/articulo/14855/shock-del-trasplante
2.3.7.3 Trasplante y adaptación bajo condiciones de invernadero
Al inicio de la temporada de cultivo, si se presentan condiciones meteorológicas inestables, es posible que los trasplantes se vean afectados. Los síntomas no dejan lugar a dudas — marchitez pronunciada, hojas y tallos secos, y en casos más graves, el colapso completo de la planta e incluso la muerte. Estos síntomas no deben confundirse con los de enfermedades tales como Caída de plántulas por Pythium o daño causado por insectos.
Conviene recordar que los trasplantes de hortalizas de temporada cálida difieren en su habilidad para resistir condiciones óptimas dependiendo del proceso de adaptación y de su capacidad inherente para resistir estrés. Tomates, pepinos, y calabacitas son más adecuados para resistir estrés que melones cantaloupe, sandías, o chiles y pimientos.
Las temperaturas del suelo son un factor clave en el establecimiento de los cultivos de temporada cálida. Es importante tender el plástico con antelación al trasplante y contar con la humedad del suelo adecuada para absorber y retener calor. Cuando las temperaturas del suelo son muy bajas, el crecimiento radicular es mínimo en estos cultivos y se demora el crecimiento y enraizado de las plántulas. Insectos y enfermedades pueden estresar a los trasplantes y reducir su capacidad de soportar inclemencias meteorológicas.
http://www.hortalizas.com/articulo/14855/shock-del-trasplante
Problemas de adaptación
Algunos problemas de adaptación se producen cuando los trasplantes son producidos en invernadero en regiones cálidas y no son expuestos al exterior hasta el día del transporte. Pero los trasplantes producidos localmente también son vulnerables al shock o colapso del trasplante si se trasladan directamente del invernadero al campo sin haber experimentado un periodo de adaptación. Y aun si se someten a dicho periodo, en condiciones de vientos fuertes, las plántulas pueden resecarse rápidamente si se dejan en el campo, particularmente si no existen rompevientos adecuados.Conviene recordar que los trasplantes de hortalizas de temporada cálida difieren en su habilidad para resistir condiciones óptimas dependiendo del proceso de adaptación y de su capacidad inherente para resistir estrés. Tomates, pepinos, y calabacitas son más adecuados para resistir estrés que melones cantaloupe, sandías, o chiles y pimientos.
Las temperaturas del suelo son un factor clave en el establecimiento de los cultivos de temporada cálida. Es importante tender el plástico con antelación al trasplante y contar con la humedad del suelo adecuada para absorber y retener calor. Cuando las temperaturas del suelo son muy bajas, el crecimiento radicular es mínimo en estos cultivos y se demora el crecimiento y enraizado de las plántulas. Insectos y enfermedades pueden estresar a los trasplantes y reducir su capacidad de soportar inclemencias meteorológicas.
http://www.hortalizas.com/articulo/14855/shock-del-trasplante
2.3.7.2 Desinfección o esterilización del sustrato
A lo largo de este bloque hemos ido comprobando cómo los microorganismos están presentes
prácticamente en casi todos los lugares de nuestro organismo, así como de nuestro entorno cercano.
El cambio de las condiciones ambientales o de las defensas del individuo puede provocar un
crecimiento excesivo de determinadas especies microbianas, algunas oportunistas, que finalmente
puede provocar una enfermedad infecciosa.
Evitar el crecimiento incontrolado de estos microorganismos y eliminarlos total o
parcialmente de aquellos productos o lugares que nos interesen, es una labor muy importante, tanto
en nuestra vida cotidiana como en nuestra actividad laboral o docente.
Diariamente nos lavamos para evitar el excesivo crecimiento de microorganismos sobre
nuestra piel, con las consecuencias que ello provoca. Estamos acostumbrados a tomar nuestros
alimentos libres de microorganismos. Cualquier producto que vayamos a introducir en nuestro
organismo debería estar libre de gérmenes. Las superficies de trabajo, los suelos, la ropa, los
enseres deben estar limpios para garantizar nuestra salud.
Es muy importante conocer las diferencias entre los tres conceptos que dan título a este tema,
sobre todo en aquello relacionado con el control y eliminación de microorganismos.
Limpiar
es cualquier proceso mecánico, físico o químico que tiene por objeto disminuir las
sustancias externas depositadas o adheridas sobre una superficie, sean microorganismos o no.
Generalmente entendemos por limpieza cualquier proceso que arrastre y elimine la suciedad
(escoba, gamuza, plumero). En ocasiones utilizamos agua en el proceso para aumentar las
posibilidades de arrastrar partículas de menor tamaño (fregona, bayeta)
Sin embargo, algunas partículas que quedan adheridas a las superficies, como las grasas, son
difícilmente eliminadas por fricción o por el agua. Para ello se utilizan los jabones o los detergentes.
No obstante, la utilización de jabones no evita la necesidad de seguir realizando un proceso de
arrastre o frotado de las superficies que queramos limpiar.
Es necesario comprender que un proceso de limpieza nunca elimina totalmente los
microorganismos presentes, sino que tan solo disminuye su cantidad absoluta. Para eliminar la
viabilidad de dichos microorganismos, hemos de someter a los productos y materiales a un proceso
final de desinfección o esterilización.
Entendemos por
desinfección el proceso que tiene por objeto destruir todos los
microorganismos, patógenos o no, que existan sobre personas, animales, ambiente, superficies o
cosas, aunque al destruir estos se eliminen también gran cantidad de microorganismos saprofitos o
residentes, pero no asegurando la eliminación de las formas de resistencia (esporas)
Si pretendemos destruir toda forma de vida, saprofita o simbionte, vegetativa o de resistencia
(esporas) utilizaremos la
esterilización, basada en métodos físicos o químicos.
La esterilización es necesaria en todos los procedimientos de laboratorio donde sea
imprescindible asegurar la ausencia de cualquier microorganismo, así como en objetos que vayan a
penetrar en el organismo atravesando la superficie corporal, o que penetren en cavidades estériles.
En el laboratorio debemos tener las manos limpias, las superficies de trabajo desinfectadas y
los medios de cultivo y reactivos utilizados, estériles. Asimismo deben esterilizarse todos los
residuos biológicos generados en el proceso analítico microbiológico.
Se denomina
desinfectante, según la FDA a "aquella sustancia química capaz de destruir en
10-15 min. los microorganismos depositados sobre cualquier material, vivo o inerte, alterando lo
menos posible el sustrato donde residen, y abarcando todas las formas vegetativas de las bacterias,
hongos y virus". El término
antiséptico se usa para aquellas sustancias que evitan la existencia o
desarrollo de gérmenes sobre la piel o mucosas, heridas, abrasiones, etc.
2.3.7.1 Tipos de sustratos
TIPOS DE SUSTRATOS.
Según sus
propiedades.
| Existen diferentes criterios de clasificación de
los sustratos, basados en el origen de los materiales, su naturaleza, sus
propiedades, su capacidad de degradación, etc. |
| Sustratos químicamente inertes. Arena granítica o silícea, grava, roca volcánica, perlita, arcilla expandida, lana de roca, etc. |
| Sustratos químicamente activos. Turbas rubias y negras, corteza de pino, vermiculita, materiales ligno-celulósicos, etc. |
| Las
diferencias entre ambos vienen determinadas por la capacidad de intercambio
catiónico o la capacidad de almacenamiento de nutrientes por parte del sustrato.
Los sustratos químicamente inertes actúan como soporte de la planta, no
interviniendo en el proceso de adsorción y fijación de los nutrientes, por lo
que han de ser suministrados mediante la solución fertilizante. Los sustratos
químicamente activos sirven de soporte a la planta pero a su vez actúan como
depósito de reserva de los nutrientes aportados mediante la fertilización.
almacenándolos o cediéndolos según las exigencias del vegetal. http://usuarios.multimania.es/theo/id114.htm |
2.3.7 Trasplante al sustrato
En el momento en que se
extraen los explantes enraizados de los frascos, están poco adaptados a crecer
en un invernáculo, ya que estos explantes han enraizado y crecido en ambientes
con una humedad relativa muy elevada y generalmente tienen estomas (estructuras
responsables de regular la transpiración y pérdida de agua en la planta) que no
son completamente funcionales frente a descensos de la humedad relativa, y por
lo tanto demasiado lentos para evitar la desecación del
explante.
crecer en ambientes tan
húmedos también suele implicar la falta de una cutícula con cera bien
desarrollada, que representa la barrera física para evitar la pérdida de agua a
lo largo de toda la superficie de la planta.
2.3.6.4 Pre adaptación y trasplante
La adaptación a la dieta posdestete puede estar afectada por la dieta predestete (Pollock
et al.
, 1994). Inducir el consumo temprano de alimento sólido, permitiría lograr un
mayor desarrollo digestivo y una mejor adaptación al consumo de alimentos sólidos al
momento del destete (Kaiser, 1976; Huber
et al., 1984). En lactación temprana, la alta relación
entre concentrado y forraje en la dieta, se cree que aumenta el área de la mucosa
del rumen, lo que contribuye al incremento de la absorción de ácidos grasos volátiles
(Liebich
et al., 1987). Algunos autores han recomendado inducir el consumo de alimento
sólido y restringir el suministro de alimentos lácteos a 8-10 % del peso vivo en la etapa
previa al destete (Appleman y Owen, 1975). Sin embargo, otros (Hodgson, 1971; Bagg
et
al.,
1985) han observado que niveles de alimentos lácteos superiores al 12 % del peso
vivo en el primer mes de vida mejoran el comportamiento general y permiten ganancias
por encima de los 600 g/día sin afectar la salud del animal. En general, se recomienda
ofrecer la dieta iniciadora desde la primera semana de vida (Owen y Larson, 1982).
El objetivo del presente trabajo fue evaluar el efecto de la preadaptación con concentrado
o heno en la dieta predestete sobre el consumo voluntario y la ganancia diaria de
peso en la etapa posdestete en terneros Aberdeen Angus separados de sus madres a los
cuatro días de edad.
El trasplante de una planta de un lugar a otro, tanto en interiores como en un ambiente exterior, puede ser necesario por cuestiones relacionadas con su salud o por motivos estéticos. En cualquier caso, conviene seguir una serie de recomendaciones para garantizar que el ejemplar no corra riesgos y que los resultados serán exitosos. Hay que acondicionar la tierra, tener cuidado al retirar el cepellón y cortar las raíces demasiado largas o deterioradas.
Suscribirse a:
Entradas (Atom)
